Giải bài 4 Ôn tập chương 1
I. Hệ thống hóa kiến thức
Hoàn thành sơ đồ hệ thống hóa kiến thức sau:
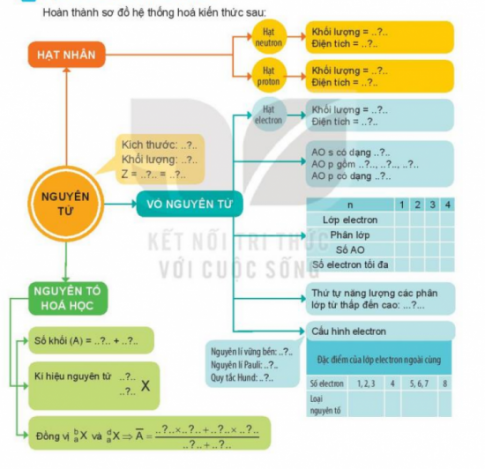
- Hạt neutron: Khối lượng = 1,675.$10^{-27}$ kg = 1amu.
Điện tích = 0
- Hạt Proton: Khối lượng = 1,672.$10^{-27}$ kg = 1amu.
Điện tích = 1,602.$10^{-19}$
- Hạt electron: Khối lượng = 9,109.$10^{-31}$ kg = 0,00055 amu.
Điện tích = −1,602.$10^{-19}$
- AO s có dạng hình cầu
- AO p gồm AO px ; AO py ; AO pz
- AO p có dạng hình số 8 nổi.
| 1 | 2 | 3 | 4 | |
| Lớp electron | K | L | M | N |
| Phân lớp | 1s | 2s, 2p | 3s, 3p, 3d | 4s, 4p, 4d, 4f |
| Số AO | 1 | 4 | 9 | 17 |
| Số electron tối đa | 2 | 8 | 18 | 34 |
Thứ tự năng lượn các phân lớp từ thấp đến cao: s, p, d, f.
Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao.
Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân tối đa và các electron này có chiều tự quay giống nhau.
Đặc điểm của lớp electron ngoài cùng
| Số electron | 1,2,3 | 4 | 5,6,7 | 8 |
| Loại nguyên tố | Kim loại | Kim loại hoặc phi kim | Phi kim | Khí hiếm (trừ He) |
Nguyên tố hóa học: Số khối (A) = Z + số neutron
- Kí hiệu nguyên tử :$_{Z}^{A}\textrm{X}$
- Đồng vị $_{a}^{b}\textrm{X}$ và $ _{a}^{ad\textrm{X}\Rightarrow \overline{A}$= $\frac{b.x+d.y}{x+y}$
- Trong đó: x và y lần lượt là tỉ lệ % số nguyên tử của $_{a}^{b}\textrm{X}$ và $_{a}^{d}\textrm{X}$
Xem toàn bộ: Giải bài 4 Ôn tập chương 1
Bình luận