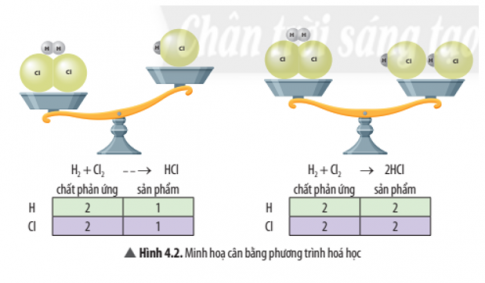
Quan sát Hình 4.2, hãy cho biết phương trình nào đã được cân bằng. Vì sao?
Thực hiện các bước lập trình hóa học
Câu hỏi 5: Quan sát Hình 4.2, hãy cho biết phương trình nào đã được cân bằng. Vì sao?
Câu hỏi 6: Quan sát sơ đồ phản ứng (*), hãy nhận xét số nguyên tử của nguyên tố P và O ở vế trái và vế phải. Số nguyên tử của nguyên tố nào lớn hơn?
Câu hỏi 7: Để cân bằng, bắt đầu cân bằng từ nguyên tố nào trước?
Câu hỏi 8: Làm thế nào để cho số nguyên tử của nguyên tố O ở 2 vế bằng nhau?
Câu hỏi 5:
Phương trình được cân bằng là: $H_{2} + Cl_{2} → 2HCl$
Do số nguyên tử của mỗi nguyên tố ở hai vế của phương trình là bằng nhau.
Câu hỏi 6:
Sơ đồ phản ứng (*): $P + O_{2} −− → P_{2}O_{5}$.
Ở vế trái: $P + O_{2}$
- Có 1 nguyên tử P và 2 nguyên tử O.
- Số nguyên tử O lớn hơn.
Ở vế phải: $P_{2}O_{5}$
- Có 2 nguyên tử P và 5 nguyên tử O.
- Số nguyên tử O lớn hơn.
Câu hỏi 7:
Để cân bằng, bắt đầu cân bằng từ nguyên tố O trước.
Câu hỏi 8:
Ta làm chẵn số nguyên tử O vế phải bằng cách đặt hệ số 2 trước $P_{2}O_{5}$:
$ P + O_{2}--\rightarrow 2P_{2}O_{5}$
Để số nguyên tử O vế trái bằng với vế phải, ta thêm hệ số 5:
$ P + 5O_{2}--\rightarrow 2P_{2}O_{5}$
Bình luận